Conoce la Leucemia Mieloide Aguda

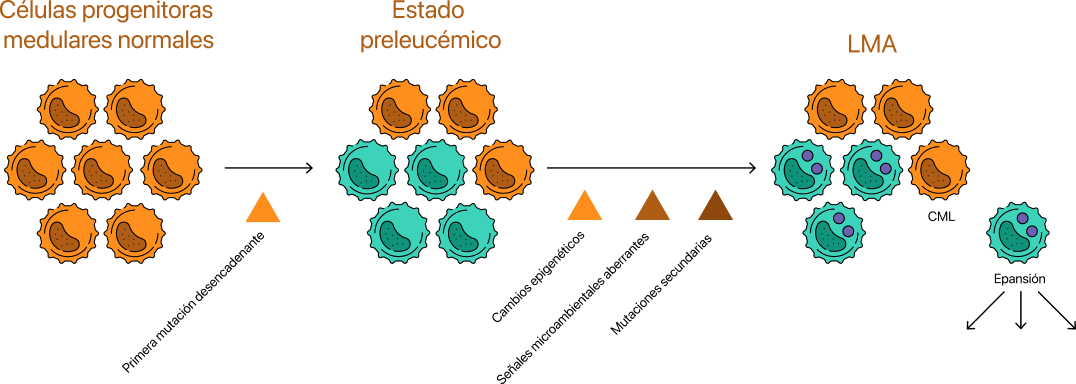
La Leucemia Mieloide Aguda (LMA) es una neoplasia hematopoyética maligna de células madre de la médula ósea, que presenta una diferenciación anómala y una acumulación clonal de células madre mieloides2,3.

Las citopenias periféricas resultantes son responsables de los síntomas clínicos más frecuentes de la LMA en el momento del diagnóstico2:
- Fatiga
- Disnea
- Fiebre e infecciones
- Hemorragia

La LMA es el tipo más frecuente de leucemia aguda en adultos, lo que supone aproximadamente el 80 % de los casos en este grupo3.
La LMA se produce por mutaciones genéticas y desregulación epigenética de células progenitoras mieloides. Estos acontecimientos favorecen la supervivencia y proliferación de células madre leucémicas (CML) y la producción de blastocitos leucémicos4,5.

Antecedentes familiares
P. ej., mutaciones asociadas a trastornos plaquetarios familiares y a SMD/LMA familiar, o algunos síndromes cancerosos hereditarios6,7

Exposición a fármacos
P. ej., exposición previa a quimioterápicos, como alquilantes, fármacos con platino o inhibidores de la topoisomerasa II3,6

Exposición ambiental
P. ej., radiaciones ionizantes, tabaquismo, benceno, disolventes orgánicos y plaguicidas6

Edad
La incidencia de la LMA depende de la edad y aumenta considerablemente en las personas ≥60 años9

Sexo
Los varones tienen un mayor riesgo10

Trastornos hematológicos
P. ej., SMD y otros trastornos mieloproliferativos crónicos3,6,8

Síndromes genéticos
P. ej., anemia de Fanconi,síndrome de Li-Fraumeni (TP53), síndrome de Down, síndrome de Patau, etc.
2000
diagnósticos al año11
4,3
pacientes / 100.000 habitantes12
68 años
Mediana de edad en el momento del diagnóstico13
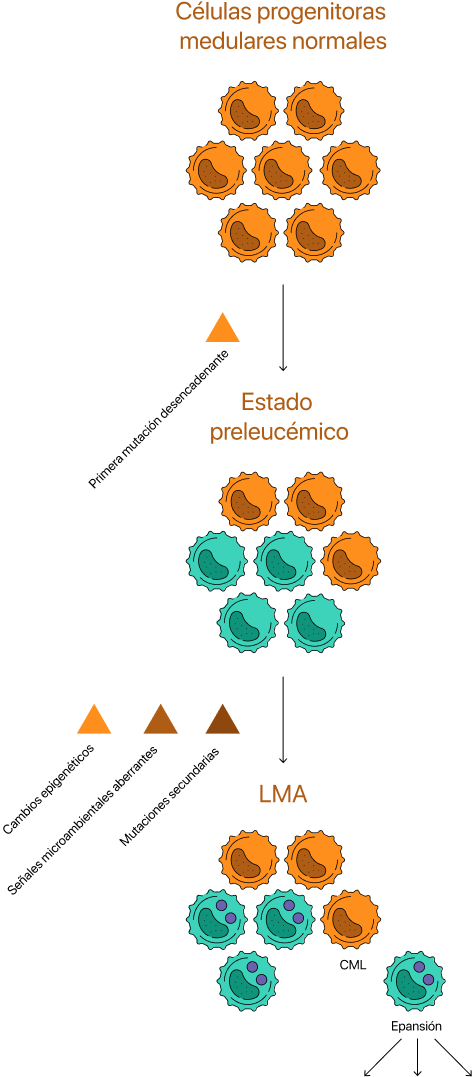
La LMA es el tipo más frecuente de leucemia aguda en adultos13. Se diagnostica con mayor frecuencia en personas de 65 a 74 años12.
Los síntomas de la LMA incluyen:
Fiebre, cansancio y debilidad14
Infiltración de células leucémicas en la piel o en las encías14
Infecciones14
Petequias y tendencia al sangrado14
Aumento del tamaño del bazo o del hígado (hepatoesplenomegalia)14
Dolor de huesos y articulaciones15
Otros síntomas inespecíficos15
Otros síntomas que pueden presentar los pacientes con LMA son:
- Leucocitosis16: blastos en sangre periférica.
- Citopenias17: anemia, trombocitopenia, neutropenia.
- Coagulación intravascular diseminada18: afección en la que se forman coágulos de sangre por todo el organismo que bloquean los vasos sanguíneos de pequeño calibre.
- Hiperuricemia19: exceso de ácido úrico en la sangre.
Sin embargo, los síntomas de la LMA pueden ser inespecíficos, y las personas pueden experimentar diferentes síntomas antes del diagnóstico15.
Diagnóstico y seguimiento
El diagnóstico de la LMA se realiza a partir de:
- La sangre periférica presenta blastocitos leucémicos
- La médula ósea muestra elevación del porcentaje de blastocitos (≥20 %)
- Los blastocitos presentan anomalías en:
- Las moléculas de la superficie celular
- Los marcadores citoplásmicos
- Mutaciones génicas
- Reordenamientos génicos
Tras el diagnóstico, los pacientes con LMA se clasifican según su riesgo citogenético y su estado de forma física para establecer el ciclo de tratamiento más adecuado2,3
Factores que determinan el tratamiento
Características de la enfermedad
Citogenética/mutaciones
GB en el momento del diagnóstico
LMA secundaria frente a LMA nuevo diagnóstico
LMA relacionada con la terapia
Características del paciente
Edad
Comorbilidades
Estado funcional
Elección del paciente
Se estima que algo más del 50,0% de los pacientes diagnosticados con LMA no son candidatos a quimioterapia intensiva de inducción (SIC)21.
Los pacientes adultos con LMA no candidatos a SIC intensiva de inducción son pacientes que presentan, de entrada, un peor pronóstico comparado con los que sí pueden ser candidatos, debido a una mayor edad, mayor número de comorbilidades y/o características biológicas desfavorables22.
A pesar de los avances en las opciones de tratamiento para la LMA, el pronóstico de los pacientes mayores (edad ≥60 años) sigue siendo desfavorable16,23-25:
En 2015, aproximadamente el 60 % de los pacientes mayores con LMA no recibían tratamiento.26
El promedio de supervivencia de los pacientes ancianos es inferior a 1 año.25
El tratamiento de intensidad baja-moderada se ofrece a pacientes no candidatos a quimioterapia de inducción estándar9,16.

El objetivo del tratamiento de baja intensidad en los pacientes no aptos a SIC consiste en mantener la enfermedad estable y mejorar la supervivencia9.
En Otsuka tenemos cada vez más claro que los recuerdos es mejor crearlos en casa.
¿Qué puede significar un tratamiento oral para un paciente con LMA, no apto para quimioterapia de inducción estándar?

Ahorro de tiempo en desplazamientos de ida y vuelta a los centros27

Necesitar menos apoyo de los cuidadores cuando acuden al hospital para recibir tratamiento27

Más tiempo fuera del entorno clínico28
Aunque los datos de Calidad de Vida Relacionada con la Salud (CVRS) específicos para pacientes adultos con LMA no candidatos a SIC son limitados, se estima que la CVRS en estos pacientes es peor que la comparada con la de la población más amplia de LMA por motivo de:
- Mayor edad29
- Mayor presencia de comorbilidades29
- Peor pronóstico en general29
Los tratamientos actuales para este grupo de pacientes se administran parenteralmente durante 5-7 días / ciclo de tratamiento30.
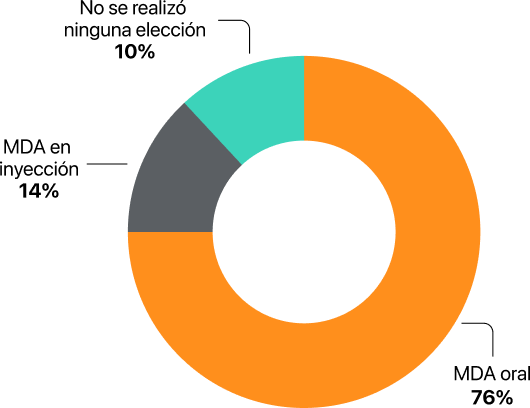
En un nuevo estudio en pacientes adultos con LMA, se investigó acerca de la preferencia del paciente ante tratamientos de similar eficacia, seguridad y diferentes vías de administración: la inmensa mayoría (76%) se decantó por la presentación oral28.
La Toma Compartida de Decisiones (TCD) es esencial para una atención centrada en el paciente31
La TCD tiene en cuenta tanto la experiencia clínica como las preferencias del paciente, ayudándole a tomar decisiones sobre su tratamiento.32
Deben tenerse en cuenta los valores de los pacientes. Deben tener un buen conocimiento y comprensión de su enfermedad y de sus opciones de tratamiento. 31,33
Preferencias y valores del paciente
Evaluación geriátrica relacionada con la edad
Riesgos/beneficios del tratamiento contra el cáncer
Una terapia oral puede proporcionar un avance terapéutico con respecto a las terapias actuales, permitiendo el tratamiento del paciente en casa y reduciendo la carga que suponen múltiples tratamientos intravenosos o subcutáneos mensuales en un entorno clínico / hospitalario30.
AHM Agentes hipometilantes
CML Célula madre leucémica
GB Glóbulos blancos
LMA Leucemia Mieloide Aguda
MDA Modo de administración
SIC Quimioterapia de inducción estándar (standard intensive quimiotherapy)
TCD Toma de decisiones compartida
- Potenza L et al. Early Palliative Care in Acute Myeloid Leukemia. Cancers. 2022;14(3):478
- Damiani D y Tiribelli M. J Lab Precis Med 2019;4:1–21
- Kouchkovsky ID y Abdul-Hay M. Blood Cancer Journal 2016;6:e441
- Thomas D and Majeti R. Blood 2017;129:1577–85
- Pandolfi et al. Stem Cells Transl Medicine 2013;2:143–50
- Short N et al. Lancet 2018;392:593–606 (apéndice complementario).
- Döhner H et al. Blood 2017:129:424–47
- Liersch R et al. Br J Haematol 2014;165:17–38
- Heuser M et al. Acute myeloid leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2020;31(6):697-712.
- Yi M et al. J Hematol Oncol 2020;13:1–16.
- Red Española de Registros de Cáncer (REDECAN) - Proyecto HematoRedecan, 2023. [Internet]. Disponible en: https://redecan.org/storage/documents/7c6e13b7-669d-4bb9-889c-7f19de00636b.pdf
- National Institutes of Health. Cancer Stat Facts: Leukemia – Acute Myeloid Leukemia (AML). Disponible en: http://seer.cancer.gov/statfacts/html/amyl.html (consultado en Junio de 2025).
- Arellano M & Carlisle JW. (2018), How I treat older patients with acute myeloid leukemia. Cancer, 124: 2472-2483. https://doi.org/10.1002/cncr.31347.
- Kulsoom B et al. J Pak Med Assoc 2017;67:1837–42
- ALAN. So, what is acute leukaemia? Disponible en: https://acuteleuk.org/acute-leukemia-info/ Consultado en Junio de 2025.
- Döhner H et al. Diagnosis and Management of AML in Adults: 2022 ELN Recommendations from an International Expert Panel. Blood. 2022;140(12): 1345-1377.
- Bumbea H et al. J Clin Med 2022:11;118
- Uchiumi H et al. Int J Hematol 2007:86;137–42
- Annemans L et al. Support Care Cancer 2003:11;249–57.
- Klepin HD et al. Definition of Unfit for Standard Acute Myeloid Leukaemia Therapy. Current Hematologic Malignancy Reports. 2016;11(6):537-544.
- Griffiths EA, Chandhok NS, et al. Advances in non-intensive chemotherapy treatment options for adults diagnosed with acute myeloid leukemia. Leuk. Res 2020;91:106339.
- Bérard E, et al. A scoring system for AML patients aged 70 years or older, eligible for intensive chemotherapy: a study based on a large European data set using the DATAML, SAL, and PETHEMA registries. Blood Cancer J 2022;12:107.
- Halik A, et al. Refining AML Treatment: The Role of Genetics in Response and Resistance Evaluation to New Agents. Cancers. 2022; 14(7):1689.
- Burnett A, et al. Therapeutic advances in acute myeloid leukemia. J Clin Oncol. 2011 Feb 10;29(5):487-94.
- Dombret H et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood. 2015;126(3):291-299.
- Medeiros BC, et al. Big data analysis of treatment patterns and outcomes among elderly acute myeloid leukemia patients in the United States. Ann Hematol. 2015 Jul;94(7):1127-38.
- Acute Leukemia Advocates Network (ALAN) Global Quality of Life Survey 2023; accessed at: https://acuteleuk.org/wp-content/uploads/2017/09/ALAN-Global-Quality-of-Life-survey_-Final-report-2023.pdf; date accessed: June 2025.
- Delmas A et al. Exploring preferences of different modes of administration of hypomethylating agent treatments among patients with acute myeloid leukemia. Front Oncol. 2023: 8;13:1160966.
- Forsythe A, et al. Systematic literature review and indirect comparison of glasdegib plus low dose Ara-C versus a Hypomethylating agent for acute myeloid leukemia patients ineligible for intensive chemotherapy. Value Health 2017;20:A415.
- Garcia-Manero G, et al. Oral cedazuridine/decitabine for MDS and CMML: a phase 2 pharmacokinetic/pharmacodynamic randomized crossover study. Blood. 2020 Aug 6;136(6):674-683.
- Shickh S et al. Shared Decision Making in the Care of Patients With Cancer. American Society of Clinical Oncology educational book. 2023;43(43). doi:10.1200/edbk_389516.
- The National Institute for Health and Care Excellence. Shared Decision Making. Available at: ww.nice.org.uk/about/what-we-do/our-programmes/nice-guidance/nice-guidelines/shared-decision-making. Accessed: June 2025
- Elwyn G et al. A three-talk model for shared decision making: multistage consultation process. BMJ. 2017;359(359):j4891
DuMontier C et al. Randomized controlled trial of geriatric consultation versus standard care in older adults with hematologic malignancies. Haematologica. 2021;107(5).